ChIP实验指南
ChIP概述
ChIP(Chromatin Immunoprecipitation)技术的主要目的是研究目的蛋白(包括:修饰组 蛋白,转录因子,辅因子及其他染色质蛋白)在染色质上的定位及丰度分析。
1993年James Broach在Genes&Dev上首次描述了染色质免疫共沉淀(ChIP)技术,研究酵 母中组蛋白乙酰化状态下的转录基因沉默。而此项技术第一次在哺乳动物细胞中成功还要归 功于Richard Treisman课题组,他们将成果发表在了1998年的Cell上。
从此ChIP走过了一段漫长的发展之路,经过全球范围内无数个实验室,不同物种样本的 尝试,才使得ChIP技术成为研究蛋白-DNA互作的经典实验方法。其下游分析也从终点PCR (endpoint-PCR)发展到如今的高通量测序(NGS,Next Generation Sequence)。
ChIP实验的基础步骤是使用甲醛溶液将DNA和作用蛋白交联固定在一起后,提取染色质 并将染色质剪切到一定的片段大小,再用染色质蛋白特异性抗体,通过免疫沉淀富集感兴趣 的染色质片段。
最初检测感兴趣的DNA是通过固定在硝化纤维素上并用与目标位点互补的DNA探针分析ChIP结果,这种方法限制了ChIP技术的灵敏度,因此基于PCR的分析检测方法应运而生,其 中包括终点PCR检测,荧光定量PCR检测。
ChIP在表观遗传学中的应用
ChIP是研究表观遗传标记映射至基因组个别位点的主要技术,表观遗传学研究主要包括组蛋白与基因表达间的关系,或是研究非组蛋白蛋白与染色质作用如何影响了基因表达,如转录因子。
ChIP技术可以帮我们解答特异性修饰组蛋白或转录因子在染色质上是如何分布的,通过分析它们的染色质定位可以为解码目的蛋白的功能提供帮助。以组蛋白修饰为例,组蛋白H3的第四位赖氨酸三甲基化(H3K4me3)主要定位在转录活跃基因的启动子CpG岛上,这提示我们H3K4me3跟转录激活相关,而组蛋白H3K27me3主要分布在转录抑制的基因上,说明H3K27me3跟转录抑制相关。
另一方面,在转录调控研究中,如果我们知道某种转录因子定位在哪些基因的启动子上,便可知这个转录因子调控哪些基因表达,其丰度的多少可以揭示这种转录因子对不同基因的调控强度。
这都需要利用免疫共沉淀技术特异富集染色质位点。ChIP技术在实验层面上是非常具有挑战性的,许多因素都可能导致其失败,因此,最好使用经过良好验证的抗体和可靠的试剂来进行这些分析。
Active Motif 研发出了ChIP-IT®系列产品,针对不同实验因素,优化试剂和实验方法,使得ChIP实验灵敏度得到大幅提高。
O 提供实验全套解决方案,使实验轻松简单
O 选用protein G 包被的磁珠,使1天完成ChIP实验成为可能
O 低细胞,转录因子不再是ChIP实验道路上的阻碍
O 260多种ChIP级抗体
ChIP实验关键步骤
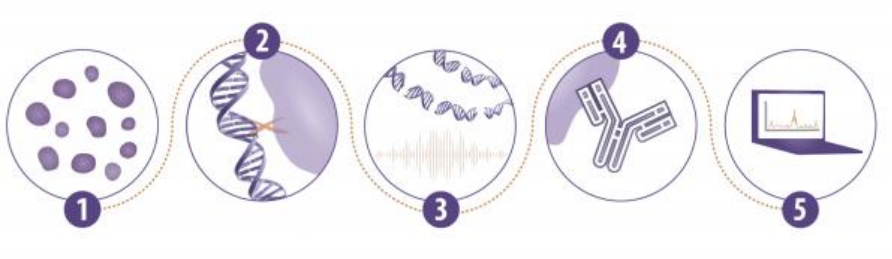
ChIP实验过程步骤繁琐,想要得到好的ChIP结果,每一步都需要细心仔细。
其中,ChIP实验中有五个关键步骤尤为重要。
1. 起始样本:每一个ChIP实验的开展,都离不开样本的选择,ChIP实验可使用细胞或组 织样本。不同的样本对应的起始量也不同。
2. 交联固定:通常进行ChIP实验时,细胞需要经过固定,保证蛋白与DNA的交联。大多 数的实验方法都是采用甲醛进行细胞固定,但也有使用不同的固定条件和固定剂。
3. 染色质片段化:制备片段化的染色质通常使用超声法,在一些条件下也会使用酶切
法。
4. 免疫沉淀:制备染色质后,下一步是实际的免疫沉淀(IP)步骤。使用的抗体是至关 重要的,决定是否使用磁性或琼脂糖珠也是至关重要的。
5. 下游数据分析:ChIP实验最后一步是数据的分析,通常是qPCR或者高通量测序。
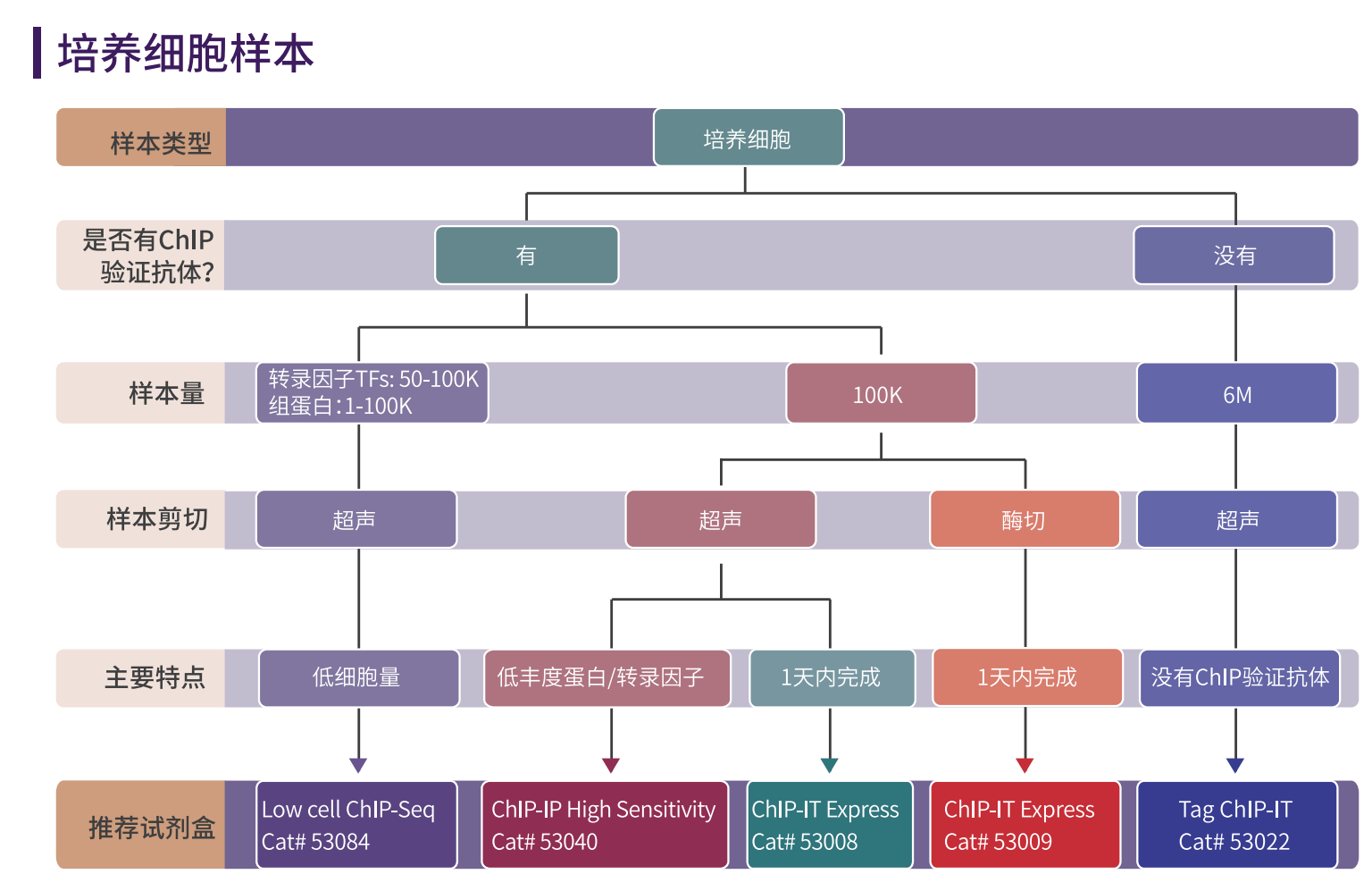
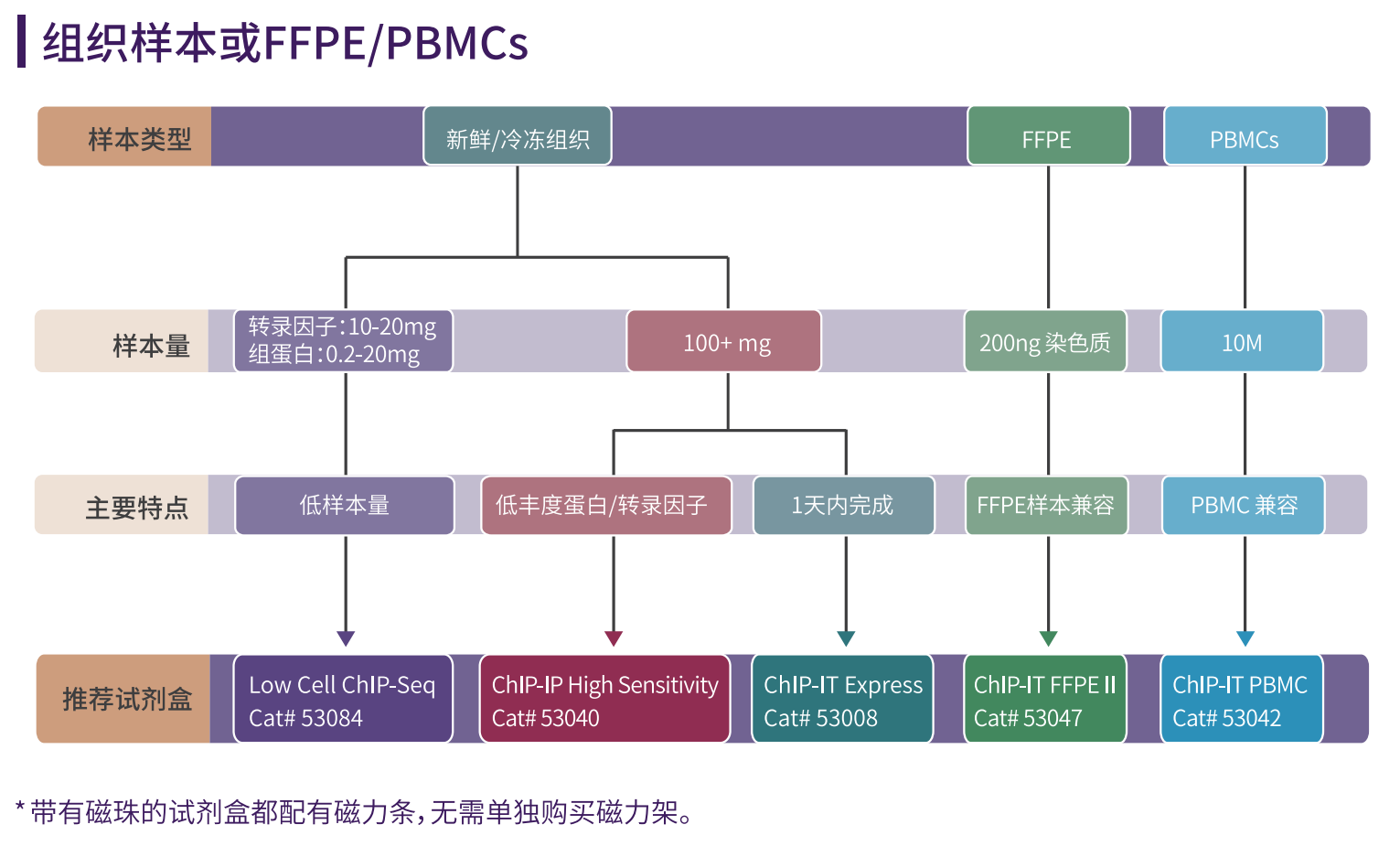
ChIP实验样本的准备
ChIP实验可以使用多样的样本类型,如组织,细胞系,FFPE等。但传统ChIP实验的开展 往往需要上百万的细胞或者大量的组织才能够满足需求,使得样本量成为了获得优良ChIP结 果的一大阻碍。
特别是对于某些样本类型,如原代细胞和干细胞,有时很难获得足够的细胞。再如一些 特殊样本,如PBMC,或者石蜡样本,用传统的ChIP方法很难得到优良的数据结果。
这就需要针对不同的样本类型优化ChIP实验。最近,随着专为低细胞起始量ChIP试剂盒 的开发,ChIP所需的细胞数量已经下降了很多。这些试剂盒已经开始允许研究人员使用几千 而不是数百万的细胞进行实验,而且每天都有新技术问世,使细胞起始需求量进一步下降, 如CUT&Tag技术(可在本书封底扫码公众号,下载/申领《CUT&Tag完全指南》)。
Active Motif基于不同ChIP实验的需求,研发出具有针对性的试剂盒产品。
ChIP试剂盒选择指南
如何正确固定实验样本
ChIP实验可以使用许多不同的样品类型,所以ChIP实验的一个重要环节就如何处理样本,在大多数ChIP实验中,都需要固定环节,固定是为了将DNA与相关蛋白质交联,不同的细胞和组织类型需要不同的固定方案。需要考虑使用的何种类型的固定剂和固定时长。
ChIP技术用到的最主要的信息保存方式是甲醛交联,最早的ChIP技术并不是使用甲醛交联的,只是后来发现甲醛能更好的保存蛋白与DNA的信息,所以后来除了用于检测组蛋白修饰分布的Native ChIP以外,其他的ChIP基本上都需要用甲醛交联。

在实际使用甲醛进行交联实验的时候,甲醛浓度和交联时间都是有严格要求的。
1.一般的甲醛交联都选用1%的甲醛浓度,室温固定10-15分钟。时间太短的话,交联反应 进行的不彻底,很多蛋白与DNA的结合不是很牢固,交联时间太长的话,会导致后续超声非 常困难,而增加超声时间或功率会破坏目的蛋白本身的结构,进而导致ChIP结果不理想。
2. 为了尽可能保存细胞原始状态下的目的蛋白在染色质上的定位,甲醛交联之前,细胞 需要尽可能少的被人为处理。可直接将甲醛加入培养基或将细胞培养基换成含有1%甲醛的PBS 交联,这样会比胰酶消化细胞以后再交联效果更好。
3. 甲醛交联反应结束之后,需要马上加入相对甲醛过量的甘氨酸(一般甘氨酸终浓度为125mM)与甲醛反应,终止交联反应。终止交联之后,样本需要经过PBS清洗(如果细胞数 量比较少的话,可以在PBS里加入0.1%-0.5% NP-40,这样细胞在转移时不会粘在管壁或培养皿 上)。
4. 组织的交联相比细胞交联要复杂一些。虽然甲醛可以很容易的透过细胞,但是大的组 织块还是不太容易交联的很均一,大的组织块交联之前需要切成小块。但组织块并不是越小 越好,组织块切的越小,细胞破坏的越严重。所以一般建议将组织块切成1-3 mm3大小。组织 的交联时间一般可以延长到15 min,这样能保证组织的充分交联。
5. 考虑到甲醛并不能很好的交联距离大于2埃的DNA和蛋白,还有一些文献报道用分子 长度更长的交联剂(一般是双官能团的亚氨酸酯类)配合甲醛对蛋白和DNA进行交联。比 如,DTBP,DMA,DSG,DSP,EGS。
染色质片段化
样本固定后,必须对其进行裂解和超声处理,以产生可溶性染色质,用于免疫沉淀反 应。一般染色质片段的期望大小在200到1000个碱基对之间,而想要得到好的染色质结果还需 要考虑多个方面。
获得细胞核中固定的染色质
在固定之后,需要从细胞核中获得片段大小足够小的染色质,才能满足抗体有效结合沉 淀。
虽然分离细胞核并不是一个绝对必需的步骤,但在片段化染色质之前,通过分离细胞 核,改善ChIP结果不失为一个好的选择。Active Motif使用dounce研磨杵(cat#40401和40415) 分离细胞核,将核分离作为ChIP实验的的标准实验步骤。这是因为我们发现细胞核的分离是 生成高质量数据的重要步骤。在细胞核被分离后,能够更轻松的获得可溶性染色质。
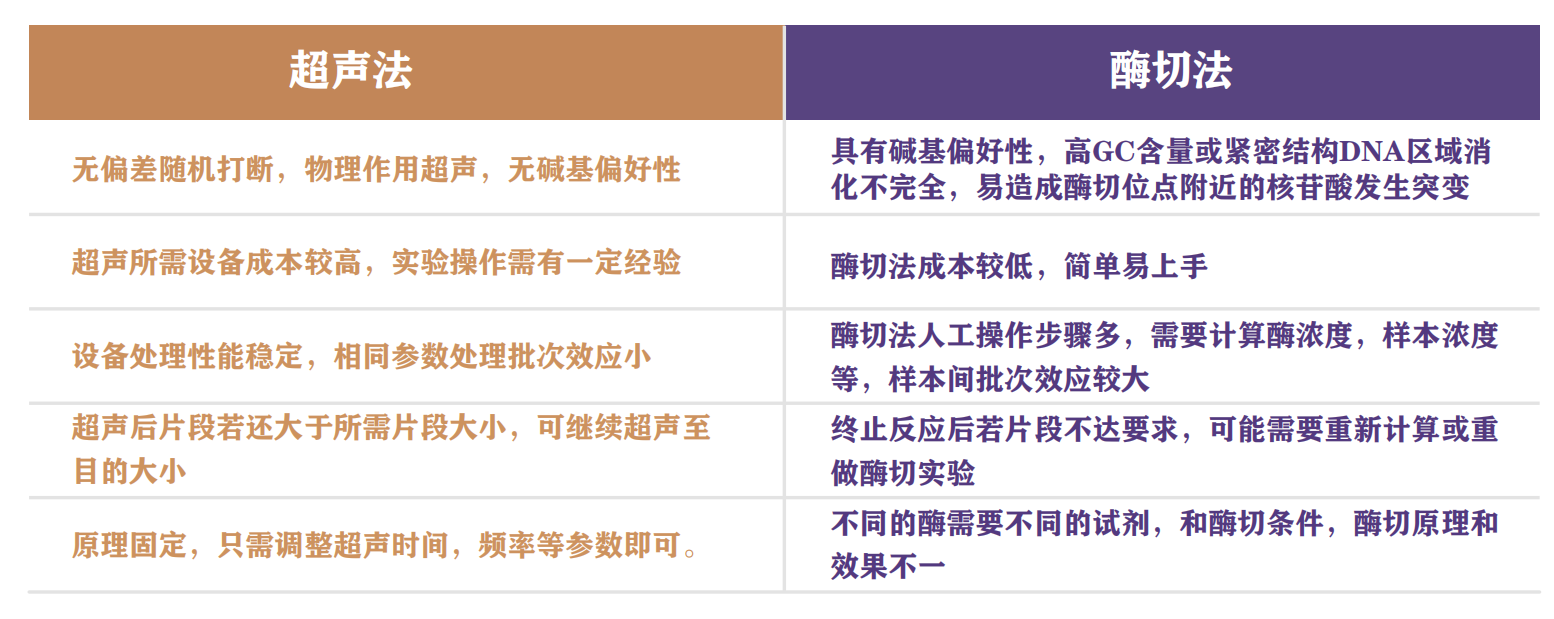
片段化染色质—— 哪一种方法才是最佳选择?
我们可以通过超声法或酶切法将染色质片段化。无论是超声或者酶切,都需要将染色质 片段化至200-1000个碱基对范围内,要确保DNA片段不能过大或者过小。超声法作为经典的方 法,被广泛的应用于ChIP实验,但针对不同的起始样本,需要对超声条件进行摸索和优化。
优化超声条件以获得最佳片段化效果
针对不同的样本类型,需要摸索对应的超声条件。但当某一细胞系,或者组织类型,确 定其超声条件后,再次使用同类型样本时,可使用相同方法进行超声。另外,像一些细胞类 型或组织由于其自身特性,也会对超声制备染色质造成困难。
样品制备本身有三个因素会对超声效果产生影响:
1. 超声用的buffer。这其中尤其以SDS的影响最大,SDS浓度越高,DNA越容易被打断。同 时盐离子和其他去垢剂浓度都会对超声产生影响,一般认为盐离子或去垢剂浓度越高,DNA 越容易被打断。
2. 细胞密度。超声时的细胞密度越高,DNA越不容易被打断。所以建议细胞密度应小于107 cells/ml裂解液。
3. 细胞类型。不同细胞类型间,超声效果差异也很大。相对于常用的肿瘤细胞系,很多原代培养的细胞以及组织细胞的染色质超声破碎会更困难些。例如,T细胞往往很难进行超声 检测,因为它们是非常小、紧密的细胞,很难打开,所以需要不同的溶解和超声条件才能实 现最好的结果。
关于超声参数选择及优化技巧参见附录二(P24)。
使用酶切法获得片段化染色质
大多数研究人员更喜欢用超声波来切割DNA,因为它高效且随机,但用超声法也有其 局限性,如需要专门的超声设备,或需要根据样本优化超声条件。一些研究者没有超声设 备,或者希望以一种温和的方式处理DNA,这种情况下酶切法不失为一个好的选择,如使用 微球菌核酸酶的剪切法(如MNase)。MNase是一种优先切割AT富集序列区域的酶,它可以 在一段时间内生成所需大小的染色质片段。而让大多数科学家对酶切法产生顾虑的主要原因 是其切割DNA具有偏好性。随着技术的发展,一些较新的染色质分析方法使用MNase与抗体 结合,使得酶切法能够应用于较低的细胞起始量(CUT&RUN技术)。
使用酶切法片段化染色质处理不同类型样本时也需要对处理条件进行优化,主要包括 酶的用量及处理时间的优化。
IP反应
抗体是决定IP结果的关键
超声之后的IP过程是ChIP成功与否的关键。首先是抗体。适用于ChIP的最佳抗体一直是 该领域的争论。多克隆比单克隆好吗?这不一定,这取决于细节。重组抗体的出现,使得争 论进入新的层面,Active Motif现在正在以重组蛋白的形式生产抗体,与传统的单克隆抗体相 比,重组蛋白抗体的一致性更高。
我们将在下面讨论每种类型的好处,以帮助您决定在实验中最好使用哪种类型。

当涉及ChIP实验时,特异性其实比抗体类型更重要
为ChIP实验选择抗体时, 最重要的是评估它是否在固定条件下以高度特异性识别靶标蛋 白质,以及它是否能够经受长时间的IP和清洗步骤保持高结合力。在ChIP问世的早期,许多 研究人员倾向于使用多克隆抗体,因多克隆抗体通常包含抗某一抗原的不同表位的抗体, 包 括一些变性的表位,所以,在固定的样本中多克隆抗体可能较单克隆抗体更具有优势。
然而现在有各种类型的抗体用于靶标蛋白,无论是单抗还是多抗,亦或是重组抗体,都 需要满足以下几点要求:
1. 识别目的蛋白的立体表位。这跟做Western Blot的抗体是有区别的,因为WB的抗体识 别的是蛋白的变性表位。
2. 识别甲醛交联后的立体表位。这跟做IP的抗体是有区别的。因为ChIP相对于IP需要甲 醛交联的过程,甲醛会在DNA和蛋白质,以及蛋白和蛋白的氨基/亚氨基之间形成共价键,所
以ChIP级的抗体还要识别甲醛交联后的目的蛋白。这跟免疫荧光的抗体有点类似。
3. ChIP级的抗体跟目的蛋白有足够强的相互作用,能够耐受高盐,低盐及多种去垢剂 (比如0.1% SDS,1%Triton X-100或NP-40)的清洗。
所以选择抗体时,最好选择文献报道可以用于ChIP实验的抗体,或抗体公司提供 ChIP-qPCR或ChIP-seq数据的抗体。若靶标蛋白无ChIP级抗体,且未见有ChIP文章的发表, 那么最好的办法就是寻找一种已经在交联实验中应用过的抗体(类似于ChIP实验的相关应 用)。具体而言,如免疫荧光(IF)和免疫组织化学(IHC)是在固定条件下进行的,因此在 这些分析中起作用的抗体很可能在ChIP实验中也可以使用。但值得强调的是,尽管抗体在IF 或IHC的固定条件下可识别蛋白质表位,但ChIP实验过程中的其他因素可能会阻止抗体发挥 良好作用。
ChIP过程使用的Buffer同样决定了IP的好坏
IP的另外一个关键因素是buffer,这包括binding buffer(超声用buffer)和wash buffer。
因为组蛋白与DNA的结合比较牢固,所以相对来说组蛋白修饰的ChIP更容易做,对 buffer的要求也不是太严格。但是对于很多转录因子来说,因为本身跟DNA不是特别紧密(很 多都是动态结合),在同一染色质区域,只有很少部分细胞可以捕获到目的蛋白和DNA的结 合,所以通过合适的buffer将目的蛋白结合的DNA与背景DNA区分并分离出来就显得很关键 了。
一般来说,选用的Buffer越剧烈,背景DNA去除的就会越干净,但同样的,目的DNA也 会被更多的清洗掉。反之,选用的buffer越温和,目的DNA得到的就会越多,但同样的,背景 DNA也就残留的越多。
对于去垢剂来说,离子型去垢剂(如SDS,SDC)比非离子型去垢剂剧烈得多。对于盐来 说,剧烈程度LiCl>NaCl>KCl。去垢剂的选择,盐和去垢剂的浓度都会对ChIP效果产生很大 影响。很多实验室或公司在这方面都有自己独到的buffer配方。
本文来自Active Motif




